生物物理学家破译肾上腺素结合受体的功能
G 蛋白偶联受体 (GPCR) 遍布人体各处,参与许多复杂的信号传导途径。尽管它们在许多生物过程中发挥着重要作用,但 G 蛋白偶联及其相关信号传递的核心机制尚不清楚。
莱比锡大学的研究团队成功在原子水平上理解了肾上腺素结合受体信号传递的机制。未来研究人员或许可以利用这些成果在药物研发过程中更好地避免副作用。
每个生物体都会对其环境作出反应。外部刺激会导致身体释放肾上腺素等信使,这些信使会与受体结合。受体将信号传递给其他蛋白质。这会触发生化级联,导致生物体做出反应,例如在肾上腺素结合受体的情况下,会出现逃跑或战斗反应。
药物通常以这些信使为基础,通过与受体相互作用发挥作用。如果药物与错误的受体结合或未将信号传递到正确的细胞内蛋白质,则会产生副作用。为了防止这种情况发生,科学家正在研究受体的工作原理。
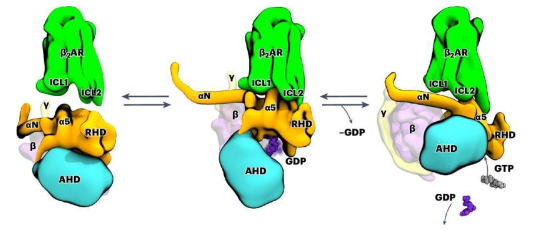
在这项研究中,莱比锡大学医学物理与生物物理研究所的 Peter Hildebrand 教授及其团队展示了信号通过 β2 肾上腺素受体在原子水平上的传递方式。这是一种 G 蛋白偶联受体 (GPCR)。该蛋白质超家族的成员嵌入细胞膜中。
研究团队利用计算机辅助分子动力学模拟以及生化和功能突变分析进行研究。这使他们能够观察到受体的工作方式:通过结合,受体会改变细胞内 G 蛋白的三维结构,然后释放调节分子 GDP。
下一步,这种G蛋白可以通过结合其实际底物GTP而被激活,并引发细胞内的生化级联反应。研究小组还发现,该受体的确切功能取决于各种灵活结构元素的排列。它们无法用经典的结构生物学方法来表征。
希尔德布兰德教授目前正计划将计算机辅助生物物理方法应用于其他受体系统,例如莱比锡大学医学研究的重点——肥胖研究。“当使用具有不同特征的药物时,动态信号的比较研究是令人兴奋的,”这位生物物理计算机模拟教授解释说。
彼得·W·希尔德布兰德 (Peter W. Hildebrand) 教授自 2017 年起在莱比锡大学医学院从事受体研究。2008 年至 2014 年,他与夏里特医学院的 Klaus-Peter Hofmann 教授和 Patrick Scheerer 博士一起研究了光感受器视紫红质的结构。
他目前还与诺贝尔奖得主 Brian Kobilka 教授和美国斯坦福大学低温电子显微镜专家 Yiorgo Skiniotis 教授合作,以更好地了解 GPCR 介导的信号传导。他们最近共同阐明了 GTP 与 G 蛋白结合及其激活的机制,并将结果发表在《自然》杂志上。
“我们现在首次全面了解了受体介导信号从细胞外部到细胞内部的结构机制,”希尔德布兰德说。“除了我的合作者之外,我的团队中才华横溢的年轻科学家 Hossein Batebi 博士和 Guillermo Pérez-Hernández 博士也功不可没。”
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
双十一购物节来临,各大电商平台的奶粉促销活动令人眼花缭乱。面对琳琅满目的产品,新手父母们最关心的问题莫...浏览全文>>
-
【美人鱼歌词周杰伦】《美人鱼》是周杰伦在2016年推出的一首歌曲,收录于他第14张专辑《周杰伦的床边故事》中...浏览全文>>
-
【美人鱼歌词林俊杰】《美人鱼》是林俊杰演唱的一首歌曲,收录在他的专辑《她说》中。这首歌以浪漫的旋律和深...浏览全文>>
-
【美人鱼电视剧剧情】《美人鱼》是一部结合奇幻、爱情与家庭元素的电视剧,讲述了人类与海洋生物之间的情感纠...浏览全文>>
-
【美人鱼的童话故事】《美人鱼的童话故事》是丹麦作家安徒生创作的经典童话之一,讲述了一位美丽的人鱼公主为...浏览全文>>
-
【美人鱼传说介绍】美人鱼是世界各地流传已久的一种神秘生物,常被描绘为上半身为人、下半身为鱼的女性形象。...浏览全文>>
-
【美人鱼2演员表名单】《美人鱼2》作为一部备受关注的奇幻喜剧电影,延续了第一部的精彩剧情和独特风格。影片...浏览全文>>
-
【美人心计演员表全部她们演古装剧太美了】《美人心计》作为一部经典古装剧,自播出以来便以其精美的服装、细...浏览全文>>
-
【美人心计演员表全部】《美人心计》是一部以西汉宫廷为背景的古装剧,讲述了窦漪房从一个普通宫女成长为皇后...浏览全文>>
-
【美甲工具全套有哪些】在进行美甲的过程中,使用合适的工具不仅能提高效率,还能保证美甲的质量和安全性。无...浏览全文>>
