氧化磷酸化的抑制为难治性遗传病提供了新的潜在治疗方法
由 CiRA 教授 Junya Toguchida 领导的研究小组与京都大学生命医学科学研究所的 Yonghui Jin 助理教授和研究生 Liping Sun 合作,确定了治疗顽固性遗传病进行性骨化性纤维发育不良 (FOP) 的有希望的治疗靶点)。
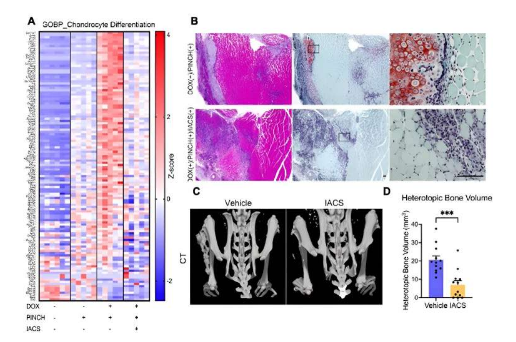
利用 FOP 患者来源的 iPS 细胞,他们发现氧化磷酸化 (OXPHOS) 的激活在 FOP 异位骨化的发展中发挥着关键作用。此外,他们的研究结果表明,OXPHOS 抑制剂可有效抑制祖细胞中的这种激活,从而显着抑制异位骨化。
FOP 是一种罕见的遗传性疾病,其特征是进行性和系统性异位骨化(软组织中骨形成异常)。大多数 FOP 患者的 ACVR1 基因存在突变,该基因编码一种 I 型 BMP(骨形态发生蛋白)受体。
通过之前与 CiRA 副教授 Makoto Ikeya 的合作,Toguchida 的团队利用源自 FOP 患者的 iPS 细胞来鉴定与触发异位骨化有关的关键分子。在这项研究中,他们发现激活素 A 通过突变的 ACVR1 错误地传递 BMP 信号,导致 mTORC1 复合物激活。
这种异常的 mTORC1 激活反过来促进由 FOP-iPSC 诱导的间充质干细胞 (MSC) 的软骨形成分化,但不促进由突变挽救的 FOP-iPSC 诱导的间充质干细胞 (MSC) 的软骨分化。基于这些结果,他们启动了使用 mTORC1 抑制剂雷帕霉素的临床试验。然而,激活的 mTORC1 下游的分子事件仍不清楚。
在生命科学联盟发表的当前研究中,研究人员首先比较了软骨形成过程中 FOP-MSC 和突变挽救的 FOP-MSC 的基因表达谱,并揭示了 FOP-MSC 中 OXPHOS 相关基因的富集。与此一致的是,他们通过质谱和耗氧率测量分别发现了软骨形成过程中 TCA 循环代谢物的上调和 ATP 产量的增加。
免责声明:本文由用户上传,与本网站立场无关。财经信息仅供读者参考,并不构成投资建议。投资者据此操作,风险自担。 如有侵权请联系删除!
-
【跳远什么鞋子防滑】在跳远运动中,鞋子的选择至关重要。一双合适的跳远鞋不仅能提升成绩,还能有效防止滑倒...浏览全文>>
-
【跳远的技巧怎样才能跳得更远】跳远是一项结合速度、力量与技巧的田径项目,想要跳得更远,不仅需要良好的身...浏览全文>>
-
【跳远的动作要领是什么】跳远是一项讲究技巧与力量结合的田径项目,运动员需要在助跑、起跳、腾空和落地四个...浏览全文>>
-
【跳远爆发力怎么在家练】跳远是一项对爆发力要求极高的运动,尤其是在起跳瞬间,腿部的力量和爆发力是决定成...浏览全文>>
-
【跳鱼儿是什么东西】“跳鱼儿”是一种在民间俗称的鱼类,主要分布于中国南方的河流、池塘和水田中。由于其跳...浏览全文>>
-
【跳线帽的作用】跳线帽,也称为短接帽或跳线封帽,是一种用于电子设备中的小型塑料元件,通常用于电路板上,...浏览全文>>
-
【跳舞毯怎么用】跳舞毯是一种常见的体感游戏设备,通常用于配合舞蹈类游戏进行互动。它通过脚部动作来控制游...浏览全文>>
-
【跳舞毯怎么跳】跳舞毯是一种流行的体感游戏设备,玩家通过踩踏不同的方向按钮来完成游戏中的动作。它不仅适...浏览全文>>
-
【跳舞毯怎么使用】跳舞毯是一种结合运动与娱乐的电子游戏设备,常见于街机、家庭娱乐系统中。它通过脚部动作...浏览全文>>
-
【跳舞毯怎么连接电视】跳舞毯是一种常见的体感游戏设备,通常用于配合电视或游戏主机进行运动类游戏。很多用...浏览全文>>
