宫颈癌是影响全世界女性的最常见恶性肿瘤之一。仅 2020 年,就有约 600,000 名女性被诊断出患有这种疾病,超过 314,000 人因此亡。在 99% 的病例中,宫颈癌细胞带有人乳头瘤病 (HPV),因此 HPV 疫苗是降低患这种疾病风险的有效方法。不幸的是,这种预防措施对已确诊的癌症毫无用处,一旦癌症发生转移或复发,通常就无法治愈。
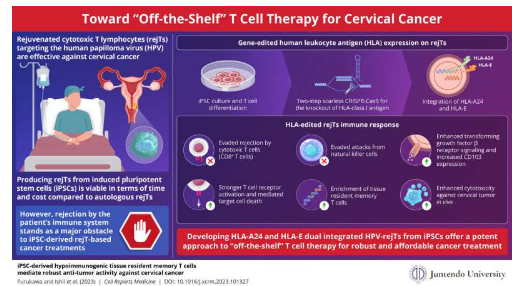
幸运的是,科学家们在开发一种有前景的宫颈癌治疗策略方面取得了实质性进展:再生细胞性 T 淋巴细胞 (rejTs)。这些淋巴细胞可以被设计为对主要在宫颈癌细胞中表达的 HPV 特异性抗原,构成一种靶向免疫疗法。理想情况下,rejT 是由从患者身上收集的诱导多能干细胞(iPSC)产生的。然而,这个过程在时间和成本方面在临床上都不可行。
在此背景下,由日本顺天堂大学医学院首席教授 Miki Ando、研究生 Yoshiki Furukawa 和助理教授 Midori Ishii 组成的研究团队最近通过开发强大的 iPSC 衍生的 rejTs 用于宫颈癌治疗,取得了突破。他们的工作发表在《细胞报告医学》上。
该团队试图解决同种异体 iPSC 衍生的 rejT 的关键障碍之一,这是指由“标准化”iPSC 产生的 rejT,而不是源自患者细胞。安藤教授解释说:“在免疫功能正常的宫颈癌患者中,主要问题是受体的 CD8+T 淋巴细胞或自然杀伤 (NK) 细胞对外来 T 淋巴细胞的排斥。”患者的免疫系统倾向于在治疗性 HPV 特异性 rejT 中和癌细胞之前攻击它们。
研究小组对来自 HPV 特异性细胞性 T 淋巴细胞克隆的 iPSC 使用 CRISPR-Cas9 两步“无疤痕”基因编辑来克服这个问题。第一个修改是从细胞中删除所有 HLA I 类抗原。这些表面蛋白的作用是将肽呈递给 CD8+T 淋巴细胞,从而迅速消除任何展示外源或异常肽的细胞。修饰后,细胞基本上能够逃避CD8+T淋巴细胞的检测。
第二个修改涉及引入两种特定 HLA 抗原的有限表达,即 HLA-A24 和 HLA-E。这使得工程细胞能够逃避 NK 细胞的攻击,NK 细胞专门对缺乏这些表面抗原的细胞。通过选择 HLA-A24,工程细胞与大部分南美、东亚、北美和欧洲人群自然相容。
在使用 CRISPR-Cas9 实施这些修饰后,研究人员诱导 iPSC 分化为 T 淋巴细胞,并在体外和体内测试它们对抗宫颈癌细胞同时逃避同种异体免疫反应的能力。这些实验产生了非常有希望的结果,因为生成的 rejT 不会触发 CD8+T 细胞或 NK 细胞的攻击,同时对肿瘤细胞具有强大的细胞性。